肌萎缩侧索硬化症(Amyotrophic lateral sclerosis, ALS)是一类特异导致运动神经元死亡的退行性疾病。额颞叶痴呆(Frontotemporal dementia,FTD),是一类以额叶和颞叶变性为特征的痴呆症候群。位于C9orf72基因5'端非编码区的六核苷酸GGGGCC序列重复扩增是导致ALS以及FTD最常见的遗传原因【1】。目前研究表明,这一重复片段的存在可以导致C9orf72基因转录效率降低,从而引起C9rof72蛋白功能不足,并最终在发病过程中发挥重要作用。因此,探究该蛋白在正常生理以及病理条件下的生物学功能,对于阐明ALS和FTD的致病机制具有十分重要的意义。越来越多的证据表明,ALS和FTD患者存在明显的代谢异常,并与疾病的发展以及预后相关【2】。线粒体作为细胞内的代谢核心,对于维持细胞的能量供给以及健康具有决定性的作用。目前并不清楚C9rof72蛋白是否参与调控细胞能量代谢与线粒体功能。2021年2月4日,约翰霍普金斯大学的王继鸥实验室 (王涛博士为第一作者)在Cell Metabolism上发表文章C9orf72 Regulates Energy Homeostasis by Stabilizing Mitochondrial Complex I Assembly,揭示出C9orf72蛋白参与调控线粒体能量代谢的分子机制。

在前期研究中,研究人员注意到C9orf72蛋白的互作蛋白约有三分之一位于线粒体,提示C9orf72与线粒体关系密切。在本项研究中,研究人员首先明确了细胞内确有一部分C9orf72蛋白可以被转运至线粒体膜间隙(Intermembrane space)中。为了进一步明确C9orf72蛋白与线粒体功能之间的联系,研究人员利用蛋白组学、代谢组学分析以及功能实验等手段,发现细胞在缺失C9orf72蛋白之后,线粒体中用于ATP生成的氧化磷酸化(Oxidative phosphorylation, OXPHOS)通路活性下调。有趣的是,这一缺陷在细胞遭遇应激时变得更加明显,并伴有细胞内ATP水平的显著降低,最终诱导细胞死亡。这一结果表明C9orf72蛋白正向调控线粒体氧化磷酸化通路活性,进而维持细胞在应激环境下的生存。氧化磷酸化通路是由线粒体内膜上的五个蛋白复合体(Complex I-V)所介导的。其中,复合体I由44个蛋白亚基组装而成,介导氧化磷酸化通路的起始。复合体I的组装过程需要依赖多种组装因子。线粒体复合体组学(Complexome)以及二维免疫印迹等结果提示,组装因子TIMMDC1在C9orf72缺陷细胞中发生特异性地下调,从而导致复合体I的组装效率不足,并伴有复合体I功能的降低。通过后续分析线粒体中C9orf72蛋白的相互作用组(interactome),研究人员发现C9orf72蛋白与抗增殖蛋白Prohibitin(PHB)有较强的相互作用。以往研究表明,PHB可在线粒体中发挥抑制内膜金属蛋白酶AFG3L2的活性【3】。后续实验发现C9orf72蛋白的确可以招募PHB来阻断复合体I组装因子TIMMDC1通过蛋白酶AFG3L2发生的降解,从而稳定复合体I的有效组装。最后,研究人员在C9orf72-ALS患者来源的细胞、组织以及iPSCs诱导来源的运动神经元中观察到了类似的氧化磷酸化通路活性下降以及复合体I的缺陷,从而提示C9orf72蛋白在线粒体中的功能缺失可能直接参与了疾病的发生和进展。
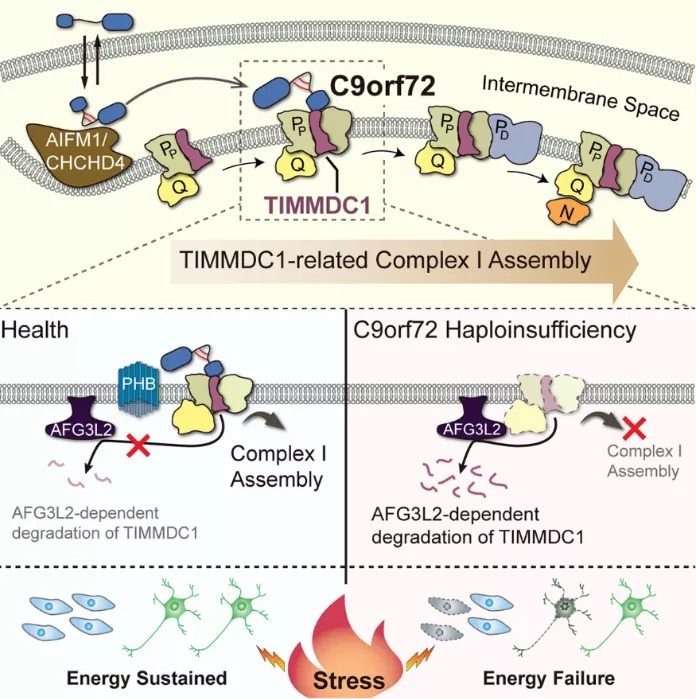
综上,该项研究阐明了C9orf72蛋白在线粒体中调控细胞能量代谢的新角色,其作为氧化磷酸化复合体I组装过程中的“守护者”,保证了细胞正常的能量代谢以及抗应激能力。而由该蛋白功能缺陷导致的能量代谢异常以及抗应激能力降低,可能在ALS以及FTD疾病进程中发挥重要作用。1. Taylor, J.P., R.H. Brown, Jr., and D.W. Cleveland, Decoding ALS: from genes to mechanism. Nature, 2016. 539(7628): p. 197-206.2. Dupuis, L., et al., Energy metabolism in amyotrophic lateral sclerosis. The Lancet Neurology, 2011. 10(1): p. 75-82.3. Steglich, G., W. Neupert, and T. Langer, Prohibitins regulate membrane protein degradation by the m-AAA protease in mitochondria. Mol Cell Biol, 1999. 19(5): p. 3435-42.
文章来源:bioart



